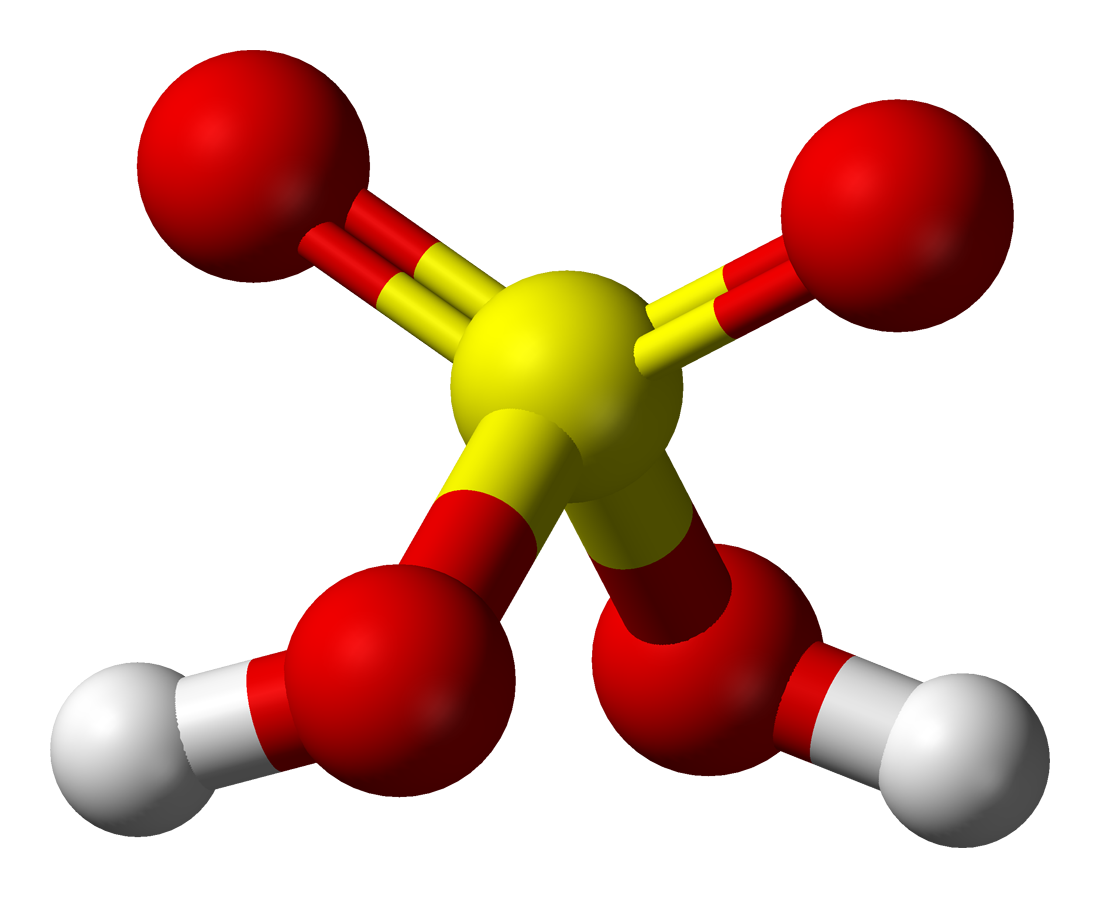
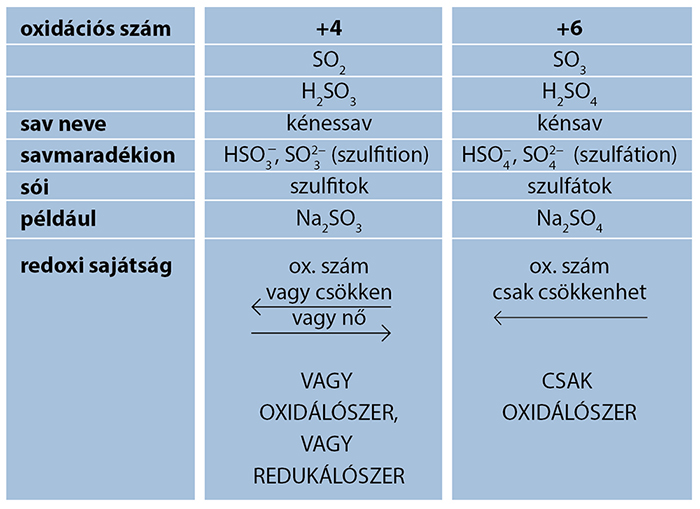
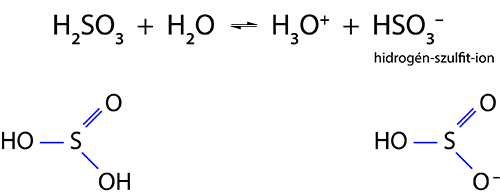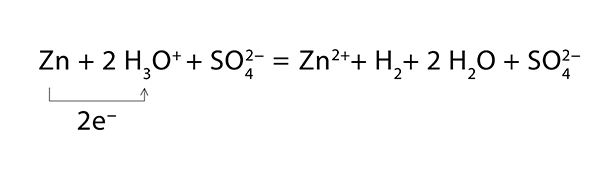Kén oxidjai és oxosavai
Mennyire savas egy eső?
Skócia: a csapadék pH-ja 2,4 (mint az ecet) Los Angeles: a csapadék pH-ja 2,2 (mint a citromlé)A savas eső eloszlása a Földön nem egyenletes. Az erősen iparosodott vidékeken (Észak-Amerika, Európa) különösen nagy a savas szennyeződés, a nagyvárosokban akár 3,0-3,5 pH-jú eső is előfordul. Magyarországon az esők nagyobb hányada a 3,8-4,7 intervallumba esik, átlagos pH-értéke nyugatról kelet felé 4,5-től 5,5-ig változik. Az országos átlag pH = 4,6. Magyarország Európában közepesen szennyezett területnek számít.
A kén-dioxid (SO2)
A kén-dioxid erős méreg, különösen a tűlevelű növények érzékenyek rá. Hidegebb időjárás esetén a tűlevelűekre lecsapódó nedvességben oldott kén-dioxid megbontja a klorofillt, és ezzel gátolja a növény asszimilációját. A levegő a nagyvárosok és a széntüzelésű hőerőművek környékén általában erősen szennyezett, a tüzelőberendezésekből a levegőbe kerülő égéstermék sok kén-dioxidot is tartalmaz, ami a környező növényzet pusztulásához vezethet.A penészgombákra is mérgező hatású a kén-dioxid, ezért használják például hordók fertőtlenítésére a borászatban (a hordókban kénlapot égetnek).A színes anyagokat kifakítja (kifehéríti), a foltokat a textíliából eltünteti. A papír- és a textiliparban fehérítőszerként használják.
Kén-dioxid az élelmiszerekben
Egy jó minőségű aszalvány gyümölcsön kívül elvben semmit nem tartalmazhat. Ennek ellenére az importált termékek jelentős részét élénk színük és tartósságuk megőrzése érdekében kén-dioxiddal (E220) kezelik. A kén-dioxidot antioxidánsként, tartósítószerként, térfogatnövelőként használja az élelmiszeripar, főként fehérborok, pezsgők, szárított gyümölcsök, lekvárok tartósításánál. A kén-dioxid, a kénessav és annak sói (E221-228) gátolják a csíraképződést és az oxidációs folyamatokat. „Cserébe" azonban egyre több allergiás reakciót (fejfájás, bőrkiütés, idegrendszeri zavarok) is okoznak.
Molekula- és halmazszerkezete, fizikai jellemzői
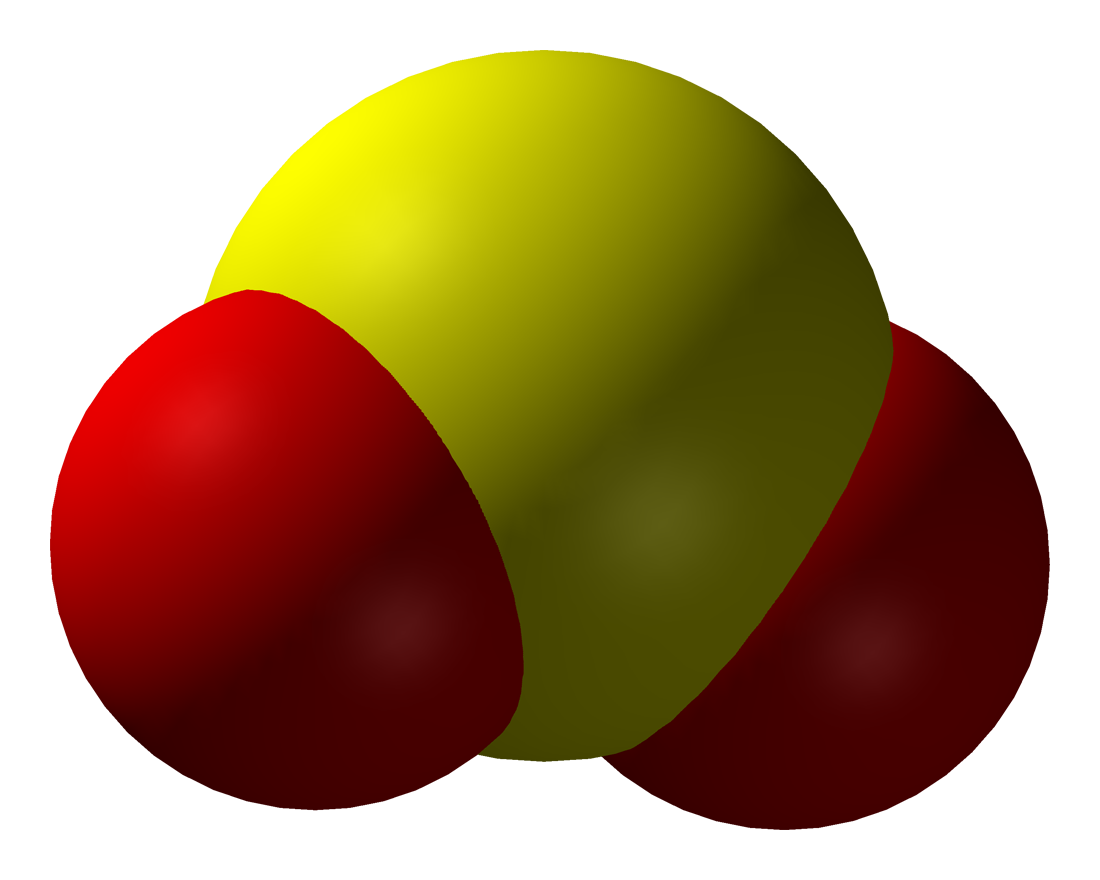
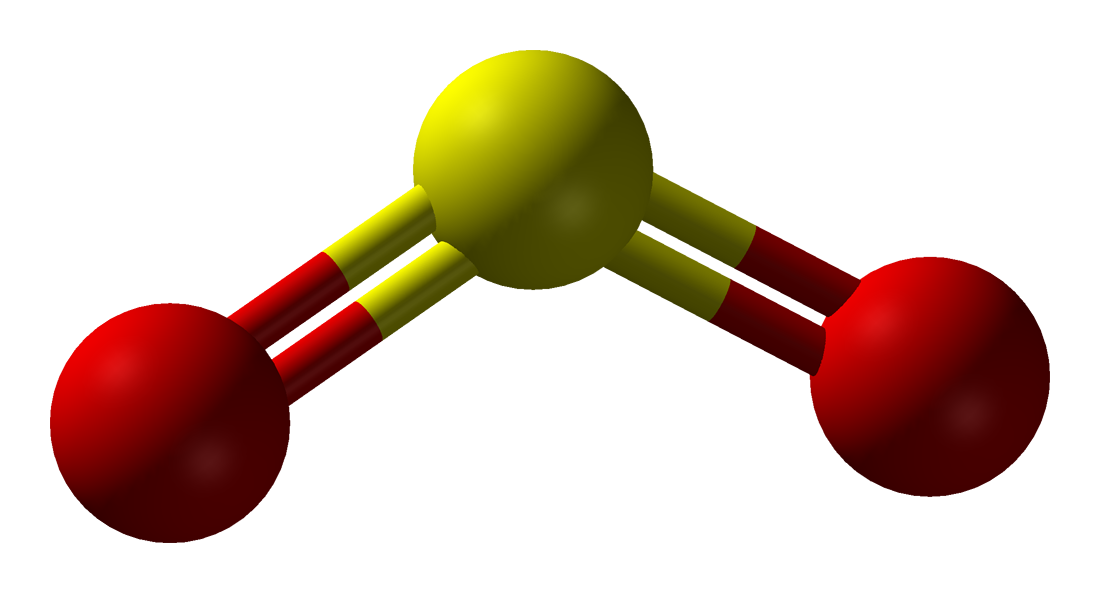
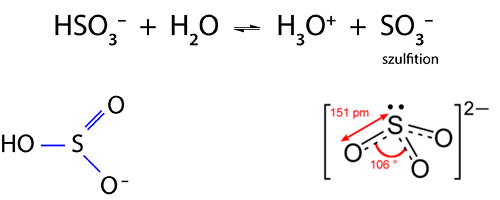
V alakú molekulát alkot, az oxigének kettős kötéssel kapcsolódnak a kénatomhoz:Az O-S-O kötésszög kb. 120°-os, a nemkötő elektronpár és a két ligandum akkor kerül egymástól a legmesszebb, ha a kénatom körül egy képzeletbeli síkháromszög csúcspontjait foglalják el. A kén-dioxid-molekula kötései polárisak, és a molekula dipólus. A molekulában a kén 4-es oxidációs számú.A kén-dioxid színtelen, szúrós szagú, köhögésre ingerlő, mérgező gáz, belélegezve a nyálkahártyát izgatja, a vörösvérsejteket roncsolja. Könnyen cseppfolyósítható, a molekulái között dipólus-dipólus kölcsönhatás lép fel. Nagy párolgáshője miatt régebben hűtőgépek hűtőfolyadékaként is használták.
Kémiai reakciói vízzel, oxigénnel
Vízben oldva kénessav keletkezik:SO2 H2O → H2SO3 kénessavA kén-dioxid oxigénnel csak magasabb hőmérsékleten, katalizátor jelenlétében, egyensúlyra vezető reakcióban egyesül:2 SO2 O2 2 SO3A reakciónak a kénsavgyártás szempontjából van gyakorlati jelentősége.A kén-dioxid további oxidációra képes, vagyis jó redukálószer.
Redoxireakciói
RedoxireakcióiA kén-dioxid többnyire redukálószerként viselkedik, amikor a 4-es oxidációs számú kénatomja 6-os oxidációs számúvá oxidálódik:Oxidációs számok: 4 0 6 -1SO2 2 H2O I2 = H2SO4 2 HIRedukáló tulajdonságán is alapul, hogy a szerves festékeket elszínteleníti.Viselkedhet azonban oxidálószerként is, ekkor a 4-es oxidációs számú kénatom 0 oxidációs számú, elemi kénné redukálódik:Oxidációs számok 4 -2 0SO2 2 H2S = 2 H2O 3 SA vulkanikus vidékeken található elemi kén vulkáni gázokból való keletkezésének egyik módja a felírt reakció.
Előállítása
Laboratóriumban kénsav redukciójával:2 H2SO4 Cu = CuSO4 SO2 2 H2Ovagy szulfitokból savval állítják elő:Na2SO3 2 HCl = 2 NaCl SO2 H2OA kén-dioxid a kénsavgyártás alapanyaga, ezért az iparban nagy mennyiségben állítják előelemi kén égetésével:S O2 = SO2vagy szulfidok pörkölésével (égetésével):4 FeS2 11 O2 = 2 Fe2O3 8 SO2 pirit vas(III)-oxid
A kéntartalmú szenek elégetésekor keletkező kén-dioxid a légkörbe jutva erősen környezetszennyező hatású.
A kénessav
A kénessav bomlékony: H2SO3 → H2O SO2,ezért tiszta állapotban, vízmentesen nem lehet előállítani. Kétértékű, gyenge sav:
Sói a szulfitok, savanyú sói a hidrogén-szulfitok. A kénessav redukáló hatásánál fogva színtelenítő, fehérítő, fertőtlenítő - ugyancsak mérgező tulajdonságú.
Kén-trioxid
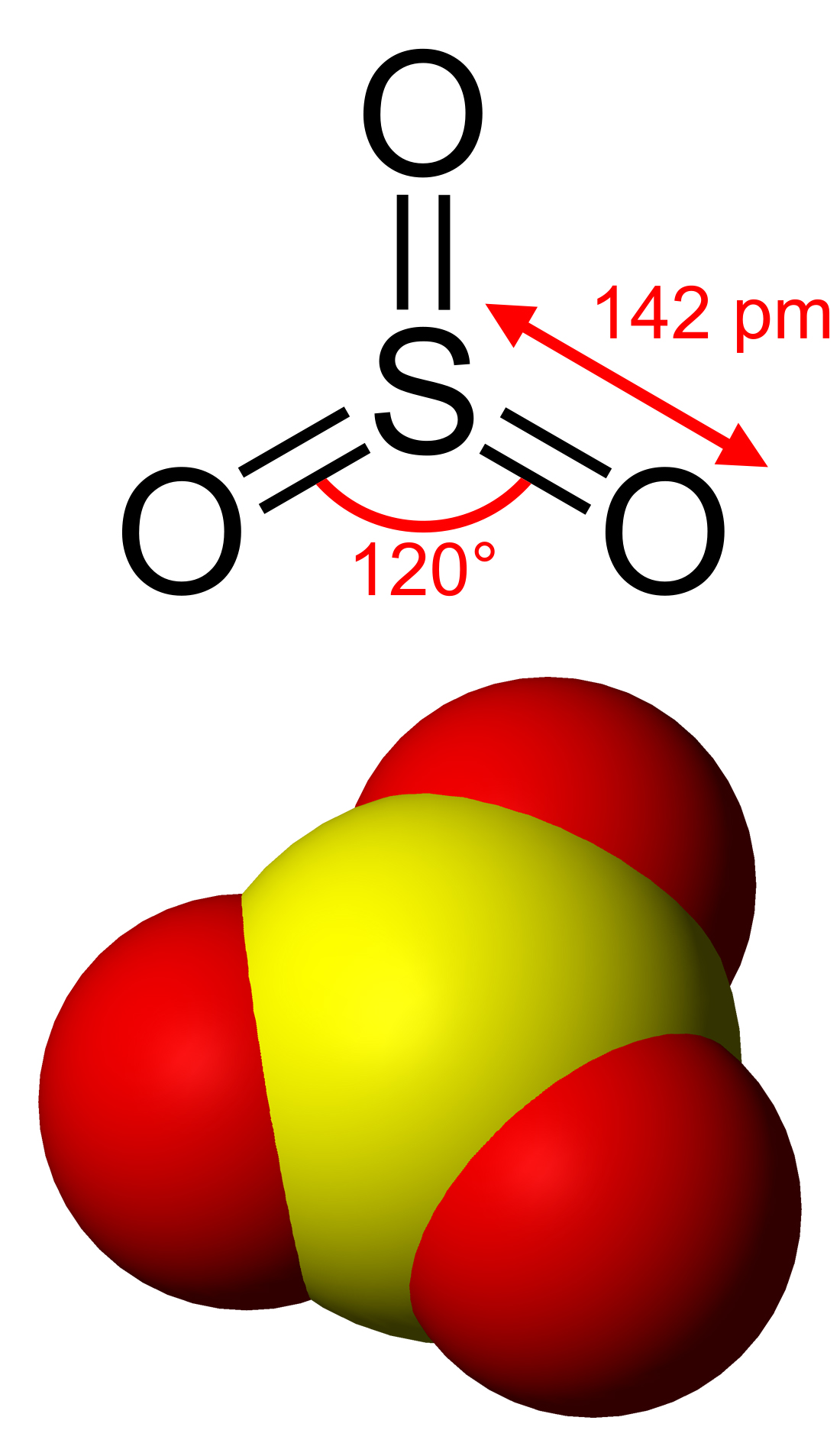
A molekula síkháromszög alakú, benne a kénatom 6-os oxidációs számú.
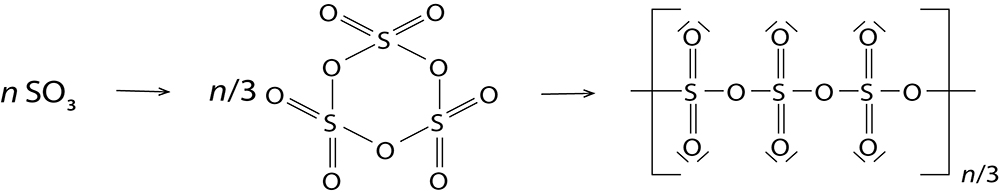
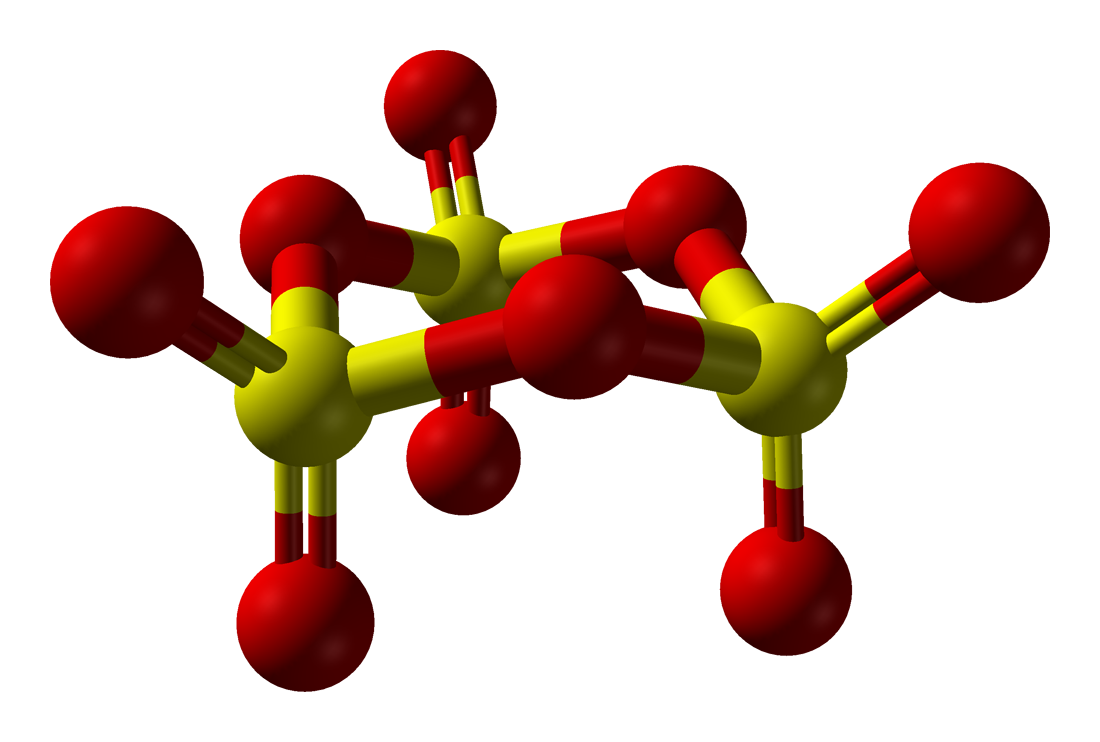
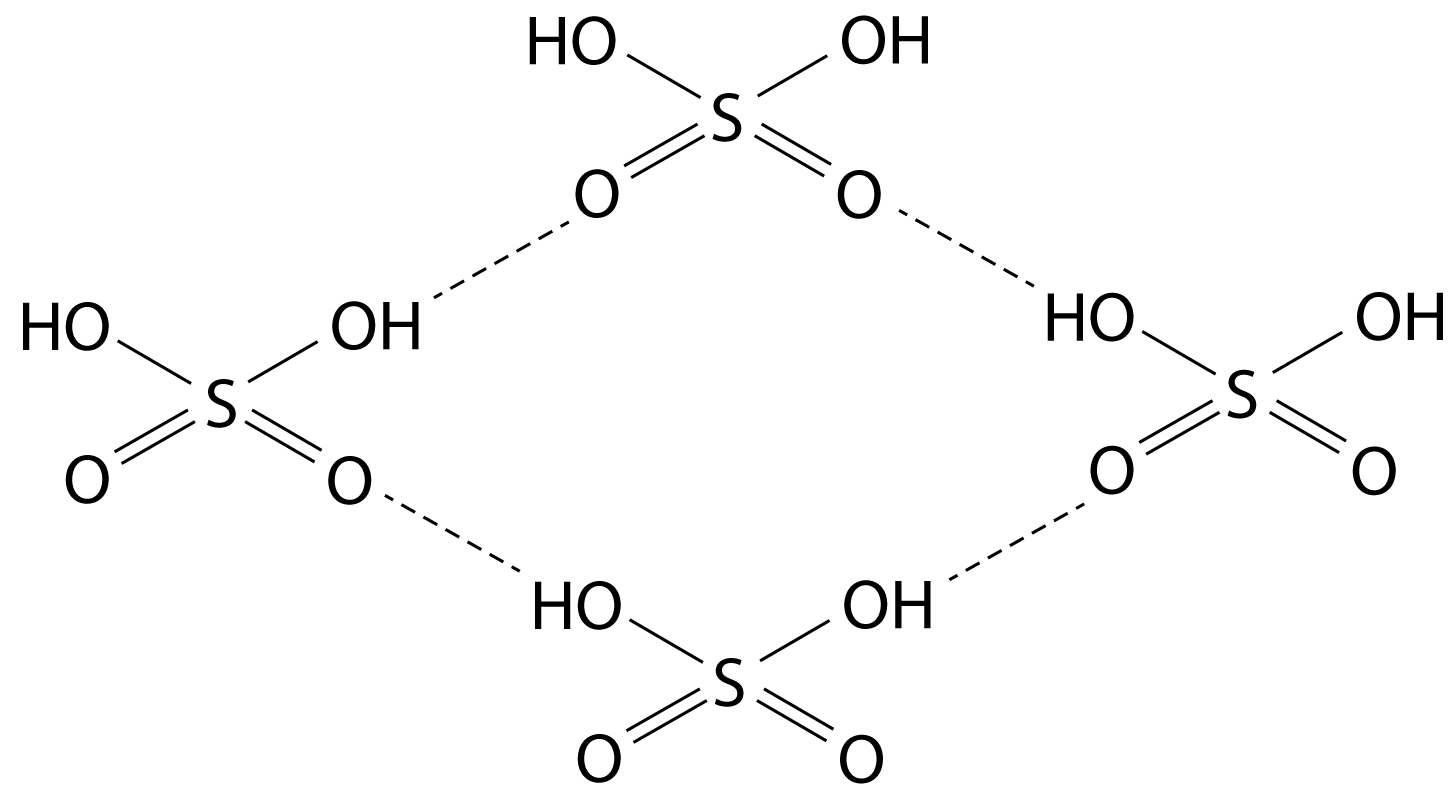
Standard körülmények között folyékony (olvadáspont: 16,8 °C), kissé lehűtve fehér kristályokat alkot.A kén-trioxid- (SO3) molekulák hajlamosak a polimerizációra: a központi kénatomhoz egy másik molekula oxigénatomja kapcsolódik a nemkötő elektronpárjával. A síkháromszög alakú SO3 molekulák S3O9 összetételű gyűrűvé, majd (SO3)n láncokká kapcsolódnak össze, s végül a láncok között térhálós szerkezet is kialakul. A különböző szerkezeteket az eltérő olvadáspontok jelzik.
Vízzel hőfejlődés közben kénsavvá alakul:H2O SO3 = H2SO4A kén-dioxidból kiinduló kénsavgyártás fontos közbülső terméke. Nagyvárosok levegőjében mint szennyező anyag fordul elő, nagyon káros, mert a levegő páratartalmával a rendkívül maró hatású kénsavat alkotja.
A kénsav
A kénsavat az iparban, a mezőgazdaságban, a laboratóriumi munkában szinte mindenütt használják. Számos fontos anyag gyártásának alapanyaga. Alkalmazzák például a műtrágya, robbanószerek előállításához, valamint oldószerként, oxidálószerként, a szerves kémiában festékek gyártásához, a kőolaj finomításához, ólomakkumulátorok töltésére.
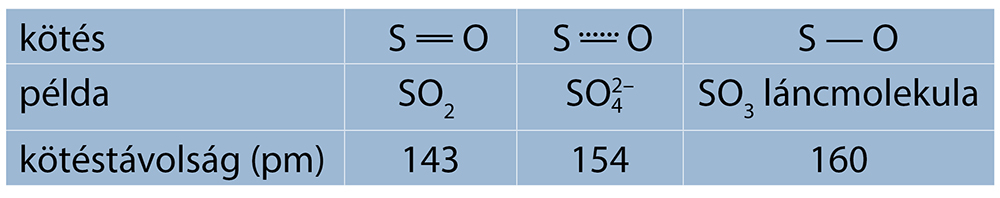
Molekulaszerkezete: elektronszerkezetéből látszik, hogy a központi kénatomtörzs 4 irányban létesít kötést, térszerkezete tehát tetraéderes, de a kettős kötés nagyobb térigénye miatt nem teljesen szabályos tetraéder.A szulfátionban két pi-elektronpár delokalizálódik, az elektronok teljesen szimmetrikusan oszlanak el, minden S-O kötés azonos kötéstávolságú, az ion szabályos tetraéder alakú. Az elektronszerkezeteket jól bizonyítják a S-O kötéstávolságok adatai.
Megoldás
A kén oxidációs száma a kénsavban is és a szulfátionban is 6.
Tulajdonságai, kémiai viselkedése
A tömény kénsav (cc.H2SO4, cc. = koncentrált, azaz a tömény rövidítése) színtelen, nagy sűrűségű (1,83 g/cm3) sav. Tiszta állapotban színtelen, sűrűn folyó, maró, roncsoló hatású kétértékű erős sav.
Magas forráspontját (338 °C) és sűrűnfolyósságát (viszkozitását) az magyarázza, hogy a kénsavmolekulák hidrogénkötéssel kapcsolódnak egymáshoz.
Kémiai viselkedését három fontos tulajdonsága köré csoportosíthatjuk:oxidáló tulajdonságú:A pozitív standardpotenciálú fémek közül sokat SO2 fejlődése közben old, a folyamatban csökken a kén oxidációs száma 6-ról 4-re:Cu 2 H2SO4 = CuSO4 SO2 2 H2Oa vizet mohón megkötierős sav
A kénsav vízelvonó tulajdonságú
A kénsav levegőn állva abból elvonja a vízpárát, ezért gázok szárítására is használják. A kristályba beépülő ún. kristályvizet is megköti. Például a szép világoskék CuSO4 ∙ 5 H2O kristályt elszínteleníti, mert megköti a kristályvizét. A kénsav a hidrogént és oxigént tartalmazó szerves vegyületekből (cukor, papír, textil stb.) is elvonja a vizet, és elszenesíti, elroncsolja azokat.
A folyamat során hő fejlődik, és más - oxidációs - folyamatok is végbemennek. Éppen ezért a bőrre került kénsav súlyos égési sebet okoz, rendkívüli mértékben maró hatású.
Még a híg kénsav is veszélyes, mert a víz párolgásával az oldat fokozatosan töményedik, roncsoló hatását tehát később fejti ki. Ezért minden esetben száraz ruhával le kell törölni a bőrre jutó kénsavat, majd bő vízzel lemosni és szódabikarbónás (NaHCO3) oldattal semlegesíteni kell a savnyomokat.
A kénsav vizes oldata erős sav
A kénsav oldása vízben erősen exoterm folyamat. A fejlődő hő az oldatot gyakran forrásig melegíti, ezért nagyon kell vigyázni a kénsav hígításakor! Mindig a tömény kénsavat öntjük a vízhez, lassan, vékony sugárban, keverés közben! Ellenkező esetben a nagy hőfejlődés következtében hirtelen gőzzé alakul a víz, és a kifröccsent sav súlyos balesetet okozhat. A kénsav reakcióba lép a vízzel:H2SO4 H2O H3O HSO4- hidrogén-szulfát-ionHSO4- H2O H3O SO42- szulfátionA kénsav savmaradékionja a szulfát-, ill. a hidrogén-szulfát-ion. Sói a szulfátok (Pl. CuSO4 ∙ 5 H2O rézgálic, CaSO4 ∙ 2 H2O gipsz, NaSO4 ∙ 10 H2O glaubersó, MgSO4 ∙ 7 H2O keserűsó).
Reakciói fémekkel
A negatív standardpotenciálú fémekkel hidrogént fejleszthet:Zn H2SO4 = ZnSO4 H2A folyamat során a fémek valójában az oxóniumionokat redukálják, a reakció lényege tehát ionos egyenletben:
Vannak azonban olyan fémek, amelyek cc. H2SO4 hatására passziválódnak, például oldhatatlan szulfátréteg keletkezik a felületükön, amely megakadályozza a fém oldódását. Ilyen fém például az ólom, a vas.
Előfordulása
A természetben a kénsav szabad állapotban csak kis mennyiségben található, egyes vulkáni vidékek folyóiban, valamint a kénvegyületek lassú oxidációjának eredményeképpen kén-hidrogént tartalmazó barlangokban (torjai Büdös-barlang). Nagyon nagy károkat okoz, ha a tüzelőanyagokból a levegőbe jutó kén-dioxid, illetve a belőle vízzel keletkező kénessav, ha lassan is, de - például a napfény hatására - kénsavvá oxidálódik, és savas eső formájában a növényekre, a talajba jut.
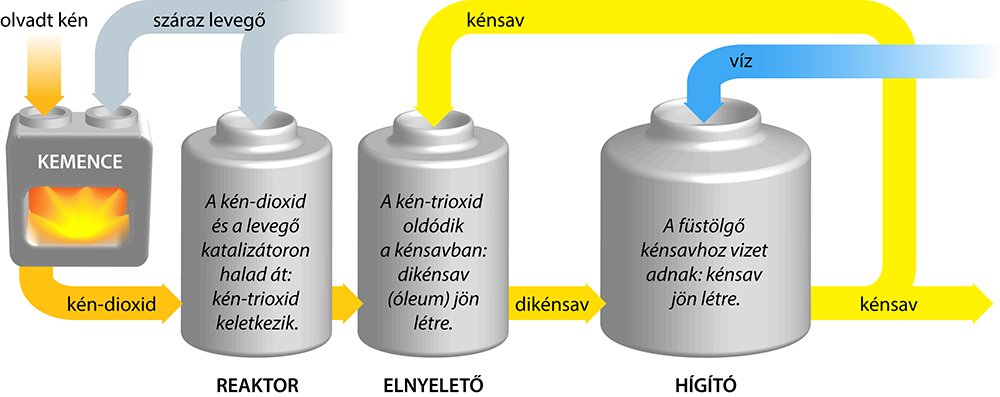
A kénsavgyártás
Az ipari kénsavgyártás kiindulási anyaga a kén-dioxid, amelyet kén égetésével vagy szulfidok pörkölésével állítanak elő. A kén-dioxidot kén-trioxiddá oxidálják:2 SO2(g) O2(g) 2 SO3(g) H = -195 kJ/molA folyamat egyensúlyra vezető, exoterm reakció. A keletkezett kén-trioxid vízzel kénsavvá alakul:SO3 H2O = H2SO4Gyakorlati okok miatt azonban nem vízben nyeletik el a kén-trioxidot, hanem kénsavban:SO3 H2SO4 = H2S2O7 dikénsavA kén-trioxid rendkívül mohón köti meg a vizet, a levegő páratartalmával is egyesül, kolloid kénsavköd keletkezik a folyadékfázis felett, ami a továbbiakban nehezen oldódik. Ezért oldják a kén-trioxidot kénsavban.A keletkező dikénsavat (pirokénsav, vitriol, óleum) vízzel kénsavvá alakítják:H2S2O7 H2O = 2 H2SO4
A kénsav felhasználása
A gépjárművek indítóakkumulátorai kivétel nélkül kénsavat tartalmazó ólomakkumulátorok. Ha egy mólnyi anyag alakul át, a töltés előállításával is járó villamosenergia-termelő elektrokémiai reakció az alábbi, amely során 53,6 Ah töltés haladhat át a vezetékeken.Három aktív anyag játszik szerepet a savas ólomakkumulátor működésében:a fém ólom (Pb), amely működéskor a negatív elektród, ólomrácsra rákent szivacsos fém ólomlemez formájában,az ólomdioxid (PbO2), amely működéskor a pozitív elektród, villamosan vezető ólomrácsra rákent szivacsos lemez formájában,az ún. elektrolitként is szolgáló kénsav (H2SO4), amely a lemezeket körbeveszi és azok pórusait is kitölti.Minden akkumulátor alapegysége az ún. akkumulátorcella, amelyben két különböző anyagú elektróda meghatározott összetételű folyadékba (elektrolitba) merül. Feltöltött állapotban az elektródák között villamos feszültség van.Ólomakkumulátoroknál a pozitív elektróda aktív anyaga ólom-oxid (PbO2), a negatív elektródáé a tiszta ólom (Pb), az elektrolit pedig desztillált vízzel hígított kénsav.
A kén vegyületeinek összefoglalása
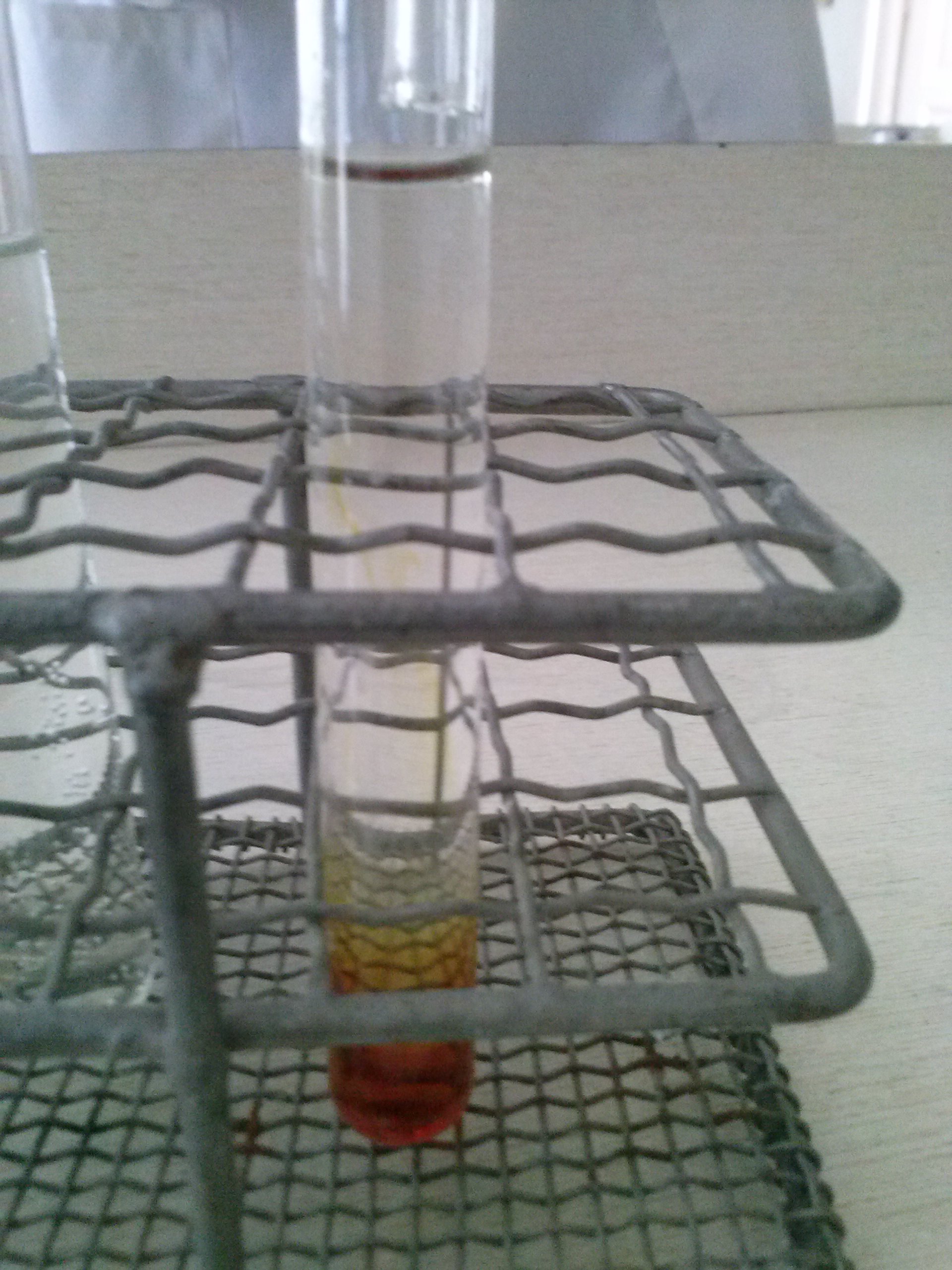
Kén-dioxid előállítása és reakciója kén-hidrogénnel, illetve Lugol-oldattal
Töltsünk Lugol-oldatot, illetve kén-hidrogénes vizet a kémcsőállványban lévő üres kémcsövekbe!Szórjunk a gázfejlesztő lombikjába 20-25 g nátrium-szulfitot!Töltsük meg a csapos tölcsért tömény sósavval!Csatlakoztassunk derékszögben meghajlított üvegcsövet a lombikhoz!Engedjük lassan a tömény sósavat a nátrium-szulfitra!Vezessük a kén-dioxidot kén-hidrogénes vízbe! Figyeljük meg a változást!Vezessük a keletkező gáz másik részletét Lugol-oldatba és figyeljük meg a változást!A kémcsőben lila gőz jelenik meg, ami a fehér vattán barna színnel csapódik le.
Tapasztalat és magyarázat
Nátrium-szulfitból tömény sósav hatására színtelen, szúrós szagú gáz keletkezik. A keletkező gázt kén-hidrogénes vízbe vezetve az oldat kezdetben opálos, majd zavaros lesz, a gázt Lugol-oldatba vezetve a barna színű oldat elszíntelenedik. A nátrium-szulfit a kénessav sója. A HCl erősebb sav, mint a kénessav (H2SO3), ezért a kénessav a nátrium-szulfitból sósavval felszabadítható.A keletkező kénessav bomlékony, kén-dioxidra és vízre bomlik.Na2SO3 2 HCl = SO2 2 NaCl H2O
A kén-dioxidot kén-hidrogénes vízbe vezetve a kénkiválás miatt a kémcsőben lévő oldat opálos lesz. A reakcióban a kén-dioxid oxidálja a kén-hidrogént.SO2 2 H2S = 3 S 2 H2OA Lugol-oldat kálium-jodid-oldatban oldott jódot tartalmaz. Az apoláris jódmolekula a poláris vízben csekély mértékben oldódik, oldhatóságát kálium-jodiddal növeljük. A kén-dioxid redukálja a Lugol-oldatból származó jódmolekulákat, ezért az oldat elszíntelenedik.SO2 2 H2O I2 = H2SO4 2 HI
Ásványi olajok kéntelenítése
Az ásványi olajok tartalmaznak kéntartalmú vegyületeket. Jelenleg az Európai Unióban, így hazánkban is a dízelgázolajok kéntartalmát 10 mg/kg-ban maximalizálták. A gázolaj (dízelolaj) kéntartalmú vegyületei a belső égésű motorokban kén-dioxiddá égnek el, ami a savas esők egyik forrása, továbbá korrozív hatása miatt a motorok és egyéb autóalkatrészek élettartamát csökkenti. A kéntelenítési technológia lényege: heterogén katalitikus hidrogénezés nagy nyomáson és magas hőmérsékleten, amikor a szervesen kötött kén kén-hidrogénné alakul, amit elemi kénné vagy kén-dioxiddá alakítanak, melyeket a vegyipar használ fel nyersanyagként.
Szulfátsók a mindennapokban
Vasgálic (FeSO4 ∙ 7 H2O): zöld kristályokat alkot. Tinták, festékek készítésére, fa konzerválására használják.Gipsz (CaSO4 ∙ 2 H2O): átlátszó kristályait máriaüvegnek nevezik, orvosi kötések készítésénél alkalmazzák. Finom szemcséjű, áttetsző változatát, az alabástromot dísztárgyak, szobrok készítésére használják.Rézgálic (CuSO4 ∙ 5 H2O): felhasználják a bőr konzerválására, festékgyártásra, galvanizálásra, valamint gombás betegségek ellen permetezőszerként.Glaubersó (Na2SO4 ∙ 10 H2O): fehér, kristályos anyag, hashajtó hatású, az üveggyártás egyik alapanyaga.Keserűsó (MgSO4 ∙ 7 H2O): fehér, kristályos anyag, a textiliparban pácok készítésére használják. A mezőgazdaságban a talaj magnéziumtartalmának növelésére használják.